解糖系

解糖系(英: Glycolysis)とは、生体内に存在する生化学反応経路の名称であり、グルコースをピルビン酸などの有機酸に分解(異化)し、グルコースに含まれる高い結合エネルギーを生物が使いやすい形に変換していくための代謝過程である。ほとんど全ての生物が解糖系を持っており、もっとも原始的な代謝系とされている。嫌気状態(けんきじょうたい、無酸素状態のこと)でも起こりうる代謝系の代表的なものである一方で、得られる還元力やピルビン酸が電子伝達系やクエン酸回路に受け渡されることで好気呼吸の一部としても機能する。
種類
解糖系にはいくつかの種類がある。
- エムデン-マイヤーホフ経路(EM経路)
- エントナー-ドウドロフ経路(ED経路)
- ペントースリン酸経路(PP経路)
このなかで、最も一般的なものがエムデン-マイヤーホフ経路であり我々のよく知る真核生物や嫌気性の真正細菌においては全てこの経路がとられている。エントナー-ドウドロフ経路は好気性の真正細菌でよく見られる。ペントースリン酸経路は、その目的のために解糖系に含まれない場合もある。また、古細菌では変形EM経路、変形ED経路という以下に述べるものとは細部の異なるものが個々の種によって選択されている。エムデン-マイヤーホフ経路は、エムデン-マイヤーホフ-パルナス経路(EMP経路)とも呼ばれる。
エムデン-マイヤーホフ経路
エムデン-マイヤーホフ経路(以下EM経路)は、真核生物、嫌気性真正細菌の糖代謝系である。EM経路では10数種類の酵素が関与しており、無酸素状態でもエネルギー通貨であるATPを生産することが可能である。
好気性の生物では好気呼吸の初段階として用いられているが、その場合はピルビン酸まで反応が進み、そこからクエン酸回路に入ることとなる。逆に無酸素状態であればピルビン酸は乳酸といった有機酸やエタノールなどに変化する。これはピルビン酸を乳酸に還元することでEM回路を続行するのに必要なNAD+などを補うためである。発酵過程はこの解糖系で発生している(乳酸発酵、エタノール発酵など)。
また、好気性の生物でも過剰な運動などによりクエン酸回路の能力を超えたATPが必要になった場合に解糖系によるATP合成が活発になりクエン酸回路で処理しきれないピルビン酸が生成され、過剰なピルビン酸が乳酸に変換されるため結果的に血中乳酸濃度が上昇する。長らく筋線維への乳酸の蓄積が運動後の筋肉痛の原因であると信じられてきたが、近年では筋線維への微細な損傷が筋肉痛の主な原因であるという考え方が主流となってきている(英語版WikipediaのLactic Acidを参照)。
ATPの収支については、反応では4分子のATPが生成されるものの、グルコースやフルクトース6リン酸のリン酸化のために2分子のATPが消費されるので、都合グルコース1分子当たりでは2分子のATPが生成されることになる。また電子伝達系に用いられるNADHは2分子の生産となる。
- 変形EM経路
一部の古細菌(テルモコックス綱やメタノコックス綱。共に嫌気性ユリアーキオータ)が使用するEM経路に類似する代謝系である。EM経路と比較してグリセルアルデヒド3-リン酸からホスホグリセリン酸への経路がバイパスされる点が大きく異なる。このため、この系で本来生み出されるATPが生成されないが、ホスホエノールピルビン酸の脱リン酸化の際に、ADPではなくAMPが消費され、ATPが生み出されるため、総合的な収支としては通常のEM経路に等しい。なお、ホスホエノールピルビン酸の脱リン酸化の際に使用されるAMPは、グルコース及びフルクトース6リン酸のリン酸化のために、ATPではなくADPが消費されることによって供給される。この点でも異なっている。
エントナー-ドウドロフ経路
エントナー-ドウドロフ経路(以下ED経路)は好気性の真正細菌によく見られる代謝系である。関与している酵素の数は少なく5種類程度である[1]。この系も無酸素状態で稼動する。
EM経路と同様グルコース1分子あたりピルビン酸2分子を生じ、無酸素状態の場合は乳酸やエタノールを生産する。ただし、ATPの収支ではグルコース1分子辺りATP1分子とEM経路よりも少なく、系が単純な分やや効率は悪い。ただしNADPHを1分子(およびNADHも1分子)生産する。
古細菌では、好気性のものや、一部の嫌気性クレンアーキオータがED経路を備えている。しかし、グルコースのリン酸化を伴わない、または一部の経路がリン酸化せずに進行するため、非リン酸化ED経路、部分リン酸化ED経路などと呼ばれている。
| 段階 | 反応物 | 生成物 | 酵素 | 反応のタイプ |
|---|---|---|---|---|
| 1 | グルコース +ATP | グルコース-6-リン酸 + ADP | ヘキソキナーゼ (EC 2.7.1.1) | リン酸化 |
| 2 | グルコース-6-リン酸 (G6P) + NADP+ | 6-ホスホグルコノ-1,5-ラクトン+ NADPH + H+ | グルコース-6-リン酸デヒドロゲナーゼ (EC 1.1.1.49) | 酸化 |
| 3 | 6-ホスホグルコノ-1,5-ラクトン + H2O | 6-ホスホグルコン酸 | 6-ホスホグルコノラクトナーゼ(EC 3.1.1.31) | 水和反応 |
| 4 | 6-ホスホグルコン酸 | 2-ケト-3-デオキシ-6-ホスホグルコン酸(KDPG) + H2O | ホスホグルコン酸デヒドラターゼ (EC 4.2.1.12) | 脱水反応 |
| 5 | 2-ケト-3-デオキシ-6-ホスホグルコン酸 | ピルビン酸 + グリセルアルデヒド-3-リン酸 | KDPGアルドラーゼ (EC 4.1.2.14) | 脱離反応 |
ペントースリン酸経路
ペントースリン酸経路(以下PP経路)は、エネルギー生産系よりはむしろ物質生産を目的としている系である。脂質、リグニンの生産に必要なNADPHや、核酸の生合成に必要なデオキシリボース・リボースといったペントースの生成に関係している。植物ではEM経路とPP経路が存在しているが、解糖のうち30%程度はPP経路に回っていると考えられている。なお、解糖系とその両端が接続されており、解糖系の一部とあわせて回路を形成していることから、ペントースリン酸回路とも呼ばれる。
過程

解糖系では細胞質基質で1分子のグルコースから2分子のピルビン酸が生成し、ミトコンドリア内で行われるクエン酸回路に引き渡す。グルコースからピルビン酸までに経る物質を以下に記す。
- グルコース
- グルコース-6-リン酸
- フルクトース-6-リン酸
- フルクトース-1,6-ビスリン酸
- ジヒドロキシアセトンリン酸 ※
- グリセルアルデヒド-3-リン酸 ※
- 1,3-ビスホスホグリセリン酸
- 3-ホスホグリセリン酸
- 2-ホスホグリセリン酸
- ホスホエノールピルビン酸
- ピルビン酸
※ジヒドロキシアセトンリン酸とグリセルアルデヒド-3-リン酸は平衡の関係にある。
準備期
解糖系前半の5ステップは準備期 (preparatory phase)と呼ばれる。準備期では2当量のATPが投入され、グルコースから最終的にグリセルアルデヒド3-リン酸 (G3P)への変換が行われる。
段階1: グルコースのリン酸化

準備期の最初のステップでグルコースは、ヘキソキナーゼ (hexokinase、EC 2.7.1.1)と呼ばれる酵素によってリン酸化される。ATPがリン酸基の供与体であり、γ-リン酸基がグルコースのC-6位に転移され、グルコース 6-リン酸(glucose 6-phosphate、G6P)が生成される。この反応はMg2+を必要とする。
ヘキソキナーゼにはいくつかのアイソザイム (isozyme)が存在する。アイソザイムとは、同じ反応を触媒するが、コードされている遺伝子の異なる酵素のことである。哺乳類の組織にはヘキソキナーゼと呼ばれるアイソザイムが4種類(ヘキソキナーゼI,II,III,IV)存在し、それぞれグルコースに対する親和性 (Km値)に差がある。ヘキソキナーゼI, II, IIIのKm値は10-6Mであるが、ヘキソキナーゼIV、別名グルコキナーゼ (glucokinase)のKm値はずっと大きく10-2 Mほどもある。理由は、グルコキナーゼが担う役割による。 グルコキナーゼは肝細胞に多く存在する。普通、血中のグルコース濃度はグルコキナーゼのグルコースに対するKmより低いためグルコキナーゼは十分に働かない。この場合はヘキソキナーゼのほかのアイソザイムが反応を触媒する。しかし、グルコース濃度が高くなればグルコキナーゼは活性を発揮しだす。グルコキナーゼが飽和することはまずないので、肝細胞のグルコース濃度が著しく高くなっても、スムーズに解糖経路やグリコーゲン合成経路に送ることができる。[2]
細胞内のグルコース濃度は細胞外より低濃度に保たれているが、これは細胞外へのグルコースの流出を防ぎ、細胞内への膜輸送を促進するためである。
段階2: グルコース 6-リン酸の異性化

2つ目のステップでは、グルコース-6-リン酸イソメラーゼ (glucose-6-phosphate isomerase、EC 5.3.1.9、別名ホスホヘキソースイソメラーゼ(phosphohexose)、ホスホグルコースイソメラーゼ(phosphohexose isomerase))により、グルコース 6-リン酸がフルクトース 6-リン酸 (Fructose 6-phosphate、F6P)に変換される。この反応もMg2+を必要とする。この反応は自由エネルギー変化が小さいためどちらの方向にも進みうるが、フルクトース 6-リン酸は次のステップでどんどん不可逆的に消費されているので逆反応は起こり辛い。
グルコース-6-リン酸イソメラーゼは、グルコース 6-リン酸のαアノマー(α-D-グルコピラノース 6-リン酸)に優先的に結合して環を開けた後、アルドースからケトースへと転換する。[3]
段階3: フルクトース 6-リン酸のリン酸化

3つ目のステップでは、ホスホフルクトキナーゼ-1 (phosphofructokinase-1、EC 2.7.1.11)がATPのリン酸基をフルクトース 6-リン酸のC1ヒドロキシ基に転移させてフルクトース 1,6-ビスリン酸 (fructose 1,6-bisphosphate、F1,6BP)を生成する。この反応もMg2+を必要とする。この反応は不可逆で、糖新生の際は別の経路を使わなければならない。また、この反応は解糖系の重要な調節点である。 なぜホスホフルクトキナーゼ-1の活性調節が重要かというと、解糖系のすべての基質がこの反応から合流するからだ。解糖系の基質はグルコースだけでなく、フルクトース、マンノースなどのグルコースのほかのヘキソースもある。これらのヘキソースは、それぞれの経路でフルクトース6リン酸になることで、この反応から解糖系に入ることが可能だ。 また、この反応は解糖系独自の段階として初めのものというのも理由として挙げられる。解糖系の段階1、段階2で合成されるグルコース 6-リン酸とフルクトース 6-リン酸はほかの経路でも消費されるが、フルクトース 1,6-ビスリン酸は解糖経路でしか代謝されない。そのため、この段階の調節は解糖系のみを操作することにつながる[3]。
ほとんどすべての植物、そしてある種原生動物や細菌では、同じ反応を触媒する酵素としてピロリン酸依存ホスホフルクトキナーゼ (Pyrophosphate dependent phosphofructokinase、PFP、PPi-PFK)を使うことがわかっている。この酵素はフルクトース 1,6-ビスリン酸の合成においてATPではなくピロリン酸(PPi)を使用する。
段階4: 開裂

解糖系の最初の3つの反応はフルクトース1,6ビスリン酸を開裂させ、2当量の異なるトリオースリン酸を作り出すための準備である。このステップでは、前の反応で生まれたフルクトース 1,6-ビスリン酸分子がフルクトース1,6-ビスリン酸アルドラーゼ (fructose1,6-bisphosphate aldolaseまたは単にアルドラーゼ aldolase、EC 4.1.2.13)によりグリセルアルデヒド 3-リン酸 (Glyceraldehyde 3-phosphate、G3P)とジヒドロキシアセトンリン酸(Dihydroxyacetone phosphate、DHAP)に分解される。準備期の目的産物であるグリセルアルデヒド3リン酸をこの段階で1当量、さらに、次の段階でもジヒドロキシアセトンリン酸から1当量獲得する。
アルドラーゼの触媒する反応は、フルクトース-1,6-ビスリン酸が開裂する方向に対して大きな正の標準自由エネルギー変化(G'° = 23.8 kJ/mol)をもたらすが、実際は細胞内でほぼ平衡状態で、解糖系の制御点にはならない。なぜなら、細胞内に存在する生成物の濃度が低いときは、実際の自由エネルギー変化が小さく、逆反応が起こりやすくなる[3]ためである。
アルドラーゼには2つのクラスが存在する。I型アルドラーゼは動物や植物に存在し、II型アルドラーゼは菌類や細菌類に存在する。両者はヘキソースの開裂機構が異なる。
段階5:トリオースリン酸の異性化

前段階でできた2種類の分子のうち、グリセルアルデヒド 3-リン酸は報酬期の最初のステップである6段階目の反応の基質となる。一方、ジヒドロキシアセトンリン酸はトリオースリン酸イソメラーゼ (triose phosphate isomerase、EC 5.3.1.1)が触媒する可逆的な反応により、速やかにグリセルアルデヒド 3-リン酸に変換される。トリオースリン酸イソメラーゼは立体選択的に反応の触媒を行うので、D体のみが生成する。ジヒドロキシアセトンリン酸から変換されてできたグリセルアルデヒド 3-リン酸の炭素1, 2, 3はグルコースの3, 2, 1位の炭素に由来し、一方の段階4で生成したほうの炭素1, 2, 3はグルコースの4, 5, 6位の炭素に由来する。しかし両グリセルアルデヒド 3-リン酸のそれぞれの位置の炭素は化学的には全く区別がつかない。
この反応により、ヘキソース分子から2当量のグリセルアルデヒド 3-リン酸が生成され、解糖の準備期は終結する。
報酬期
解糖系後半の5ステップを報酬期 (payoff phase)と呼ぶ。報酬期では2分子のグリセルアルデヒド3-リン酸がピルビン酸へ変換され、グルコース1分子あたり4分子のADPがATPへと変換され、グルコースの自由エネルギーの一部が保存される。準備期で2分子のATPが消費されているので、解糖系通じてのATPの純益は2分子となる。またグルコース1分子あたり2分子のNADHが生成される。
段階6: グリセルアルデヒド 3-リン酸の酸化
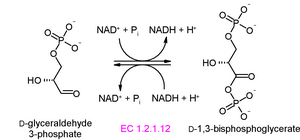
報酬期の最初のステップでは、グリセルアルデヒド 3-リン酸がグリセルアルデヒド-3-リン酸デヒドロゲナーゼ (リン酸化) (glyceraldehyde-3-phosphate dehydrogenase (phosphorylating)、EC 1.2.1.12)の触媒する反応により、1,3-ビスホスホグリセリン酸 (1,3-bisphosphoglycerate)に変換される。グリセルアルデヒド 3-リン酸のアルデヒド基が脱水素され、1分子のNAD+がNADHに変換される。グリセルアルデヒド 3-リン酸のアルデヒド結合が酸化されると、標準自由エネルギーが大きく減り、減ったエネルギーの多くはアシルリン酸基に保存される[2]。アシルリン酸とはカルボン酸#アシル基(R-CO- )とリン酸のエステル結合をもつ物質の総称で、加水分解時のエネルギー放出が極めて大きい()(→高エネルギーリン酸化合物)。このエネルギーが次の段階でADPからATPを生成するのに必要である。
Hg2+などの重金属が酵素の活性部位のシステインと反応した場合、酵素反応が不可逆に阻害される。
NAD+は細胞内に限られた量しか存在しないため、NADHが再び酸化されNAD+が絶え間なく供給されなければ反応はストップしてしまう。NADHが再酸化される反応の例としてアルコール発酵や乳酸発酵がある。
段階7: 1,3-ビスホスホグリセリン酸からADPへのリン酸基の転移

報酬期の2番目のステップではホスホグリセリン酸キナーゼ (phosphoglycerate kinase、PGK、EC 2.7.2.3)の触媒により、1,3-ビスホスホグリセリン酸からADPへと高エネルギーのリン酸基が転移し、ATPと3-ホスホグリセリン酸 (3-phosphoglycerate)が生成する。解糖系の2つの基質レベルのリン酸化 (substrate-lebel phosphoryation)の内1つである。この反応はMg2+を必要とする。段階6のアルデヒドの酸化と段階7のATPの生成は共役して、1,3-ビスホスホグリセリン酸を中間体とするエネルギー共役反応を構成する。
最初のアシルリン酸基の形成反応は吸エルゴン反応で、次のATPの生成は強い発エルゴン反応である。二つの反応を合計すると以下の式で表すことができる。反応全体では発エルゴン反応である。
グリセルアルデヒド 3-リン酸 + ADP + Pi + NAD+ 3-ホスホグリセリン酸 + ATP + NADH + H+(ΔG'°= -12.5 kJ/mol)
段階8: リン酸基の分子内転移

このステップの反応は異性化ではなくムターゼによる分子内転移であることに注意。グリセリン酸のリン酸基がホスホグリセリン酸ムターゼ (phosphoglycerate mutase、PGM、EC 5.4.2.1)の触媒により可逆的に転移し、2-ホスホグリセリン酸 (2-phosphoglycerate)に変換される。この反応はMg2+を必要とする。
この反応は2段階で行われるが、反応機構は動物と植物で異なる。動物では酵素の活性化部位のHis残基が前もってリン酸化されており、それが3-ホスホグリセリン酸のC2位のヒドロキシ基に転移し、中間体2,3-ビスホスホグリセリン酸 (2,3BPGまたは単にBPG)が生成する。次に2,3BPGのC3位から同じHis残基にリン酸基を転移し、リン酸化された酵素が再生するとともに2-ホスホグリセリン酸が生成する。ホグリセリン酸ムターゼがまず最初にリン酸化されるためには、2,3-ビスホスホグリセリン酸が必要である。つまり触媒反応を開始するためには少量の2,3-ビスホスホグリセリン酸が常に細胞内に蓄えられていなくてはならない。植物では2,3-ビスホスホグリセリン酸中間体を作らない。まず酵素に3-ホスホグリセリン酸が結合し、活性化部位にリン酸基が転移する。このリン酸基がC2位に戻されることによって2-ホスホグリセリン酸が生成する。[2]
段階9: 2-ホスホグリセリン酸の脱水

報酬期の4番目のステップでは再び高エネルギーリン酸転移ポテンシャルを有する化合物を生成する。ホスホピルビン酸ヒドラターゼ (phosphopyruvate hydratase、EC 4.2.1.11)の触媒反応によって2-ホスホグリセリン酸のC2位とC3位からH2Oが可逆的に脱離され、ホスホエノールピルビン酸 (phosphoenolpyruvate、PEP)に変換される。ピルビン酸が不安定なエノールを固定しているため、リン酸転移ポテンシャルは極めて高い。参考としてリン酸基加水分解の標準自由エネルギーは、反応物である3-ホスホグリセリン酸がΔG = -17.6 kJ/mol、生成物であるホスホエノールピルビン酸がΔG = -61.9 kJ/mol[3]。両化合物の保有する総エネルギー量はほぼ同じであるが、脱水反応によってエネルギーの再分布が起こるのである。
この反応を進めるためには2つのMg2+の関与を必要とする。1つは"コンホメーション性の (conformational)"イオンで基質のカルボキシ基に結合する。もう1つは"触媒性の (catalytic)"イオンでカルボキシ基とリン酸基に結合する。2つのイオンが酸化を打ち消し、エノラーゼの活性中心のリシン残基がC-2位の水素原子を引き抜き、エノラーゼのグルタミン酸残基の水素原子と3位のOHとがH2Oを形成する。[4]
段階10: ホスホエノールピルビン酸からADPへのリン酸基の転移

解糖経路最後のステップは、ピルビン酸キナーゼ (pyruvate kinase、EC番号 2.7.1.40)の触媒によるホスホエノールピルビン酸からADPへのリン酸基の転移であり、ピルビン酸 (pyruvate)とATPが生成する。[5]
この反応にはK+およびMg2+またはMn2+のどちらかが必要[3]で、また、第二の基質レベルのリン酸化であり、細胞内の条件では不可逆な反応で、重要な調節点の一つである。ホスホエノールピルビン酸のリン酸無水結合の加水分解で放出されたエネルギーの約半分 (30.5kJ/mol)はATPに保存される。
解糖系への供給経路
解糖系の第一段階の基質はグルコースであるから、この回路にグルコースを供給することで解糖系が動きだす。その供給の一部は糖新生によるが、このほかにもグルコースの供給経路がある。また、段階1から先の段階へと基質を導入するための経路も存在する。ここでは、糖新生以外のこれらの供給経路を紹介する。
グリコーゲン、デンプン
グリコーゲンまたはデンプンからグルコース-6-リン酸を合成する一連の化学反応がある[3]。動物組織や微生物ではグリコーゲンをグリコーゲンホスホリラーゼ(glycogen phosphorylase)、植物ではデンプンをデンプンホスホリラーゼ(starch phosphorylase)の触媒により供給反応を開始する。これらの触媒は、グルコース-1-リン酸と、1グルコース単位分だけ短くなったポリマーを生成する。すなわち、この反応は異化反応である。グルコースのポリマーは再び酵素により1グルコース単位分ずつ切られていき、分岐点から4グルコース残基を残すところまでこれを繰り返される。分岐点近くでグリコーゲンホスホリラーゼまたはデンプンホスホリラーゼの活動はいったん停止するが、この後も異化反応は続く。
異化反応の次の段階は、2種類の酵素の動きを止めている分岐を除去することだ。この作業は脱分岐酵素(debranching enzyme)によって二段階で進む。脱分岐酵素は最終的に分岐点から伸びているのグルコースの「枝」のうちの一本をポリマーの非還元末端に転移させる。分岐を失ったポリマーを再びグリコーゲンホスホリラーゼまたはデンプンホスホリラーゼが異化していく。
こうして、いくつも生み出されたグルコース-1リン酸は、ホスホグルコムターゼ(phosphoglucomutase)の触媒によりグルコース-6-リン酸となる。これは可逆反応だ。グルコース-6-リン酸は解糖系の1段階やペントースリン酸経路へと供給される。
食餌中の栄養素
人の消化器系において、食餌中の多糖や二糖を解糖系で消費するための糖へと変換するプロセスがある[3]。ほとんどの場合、食餌中の糖の供給源はデンプンである。デンプンの消化は口の中で始まる。まず、口腔に分泌される唾液に含まれるα-アミラーゼによりデンプンは長鎖の断片またはオリゴ糖に分解される。つづいて、食物が唾液とともに胃の中へと落ちるが、ここでα-アミラーゼはpHが低いため不活性化されてしまう。次の消化は膵臓から小腸に分泌された別のα-アミラーゼにより行われる。膵臓のα-アミラーゼは主にマルトースやマルトトリオース、限界デキストリン、あるいはα(1→6)分岐点を含むアミロペクチンの断片を生む。このうち、マルトースとデキストリンはそれぞれ小腸の刷子縁膜に付着している酵素マルターゼ、デキストリナーゼにより単糖へと分解される。
- デキストリン + nH2O → nD-グルコース
- マルトース + H2O → 2 D-グルコース
栄養は小腸の細胞に吸収されなければ解糖系などで活躍できない。そのため、デンプンから最終的にD-グルコースに獲得する酵素が小腸に存在する。デンプン以外の栄養素から由来する他の二糖ラクトース、スクロース、トレハロースも、単糖へと分解する酵素反応は小腸の表面で行われる。それぞれの酵素はラクターゼ、スクラーゼ、トレハラーゼ。
これらの単糖は、体中の細胞の中で解糖系の準備期のそれぞれの段階に導入される。この導入のためにATPを1当量必要とする、それぞれ異なる酵素反応を受ける。D-グルコースはヘキソキナーゼの触媒によりグルコース-6-リン酸となり、段階1に導入される。D-フルクトースもヘキソキナーゼの触媒を受けるが、こちらは段階2の基質であるフルクトース-6-リン酸となる。D-ガラクトースはさまざまな反応を経て段階1の供給に利用される。
食餌中のグリコーゲンもデンプンと非常によく似た構造をしており、その消化経路は同じ[3]。
所在
全ての生物で解糖系はその反応が細胞質基質で起こる。これは解糖系が細胞内小器官が発生する以前から存在する最も原始的な代謝系であることを反映しているのだろう。真核生物では、解糖系でえられた物質をクエン酸回路や電子伝達系の反応がおこるミトコンドリアに輸送し、好気呼吸を行う[6][信頼性要検証]。
細胞質基質の解糖系で生成されたピルビン酸は還元されて乳酸に変換される。乳酸の代謝では細胞膜を通過して他の細胞へ乳酸が輸送される必要がある場合がある。この乳酸の輸送にはいくつかの種類のトランスポーター(Monocarboxylate Transporter (MCT))が存在する。例えば、グリコーゲンが速筋線維で分解され乳酸を生成し、その乳酸が遅筋線維や心筋のミトコンドリアで使われている場合がある[7]。
役割
解糖系は多くの生物の糖代謝で最も基本的な代謝系である。解糖系でえられたピルビン酸は、アセチルCoAや乳酸の材料となる。解糖系ではエネルギー通貨ATPならびに電子伝達系で用いるNADHも生産される。また、乳酸発酵やエタノール発酵の正体は、解糖系の過程で生じたNADHを酸化しNAD+を再生することで、酸素などの電子受容体非存在下でも糖さえあれば解糖系が動き続けられるようにするための経路である。
解糖系によるATP合成はクエン酸回路によるATP 合成の約100倍の速度を持つ。このため、激しい無酸素運動などでは解糖系によるATP合成が活発になる[8]。
解糖系における生化学振動
生化学振動とは、生物、とくに細胞内において概日リズムなどサーカリズム(英: circa-rhythm)の発現に関わる化学反応系であり、時間生物学で盛んに研究されている。解糖系の中間代謝物は生化学振動することが知られており、酵母における解糖振動(英語: Glycolytic Oscillations)が実験系理論系ともに詳しく研究されている。[9]
参考文献
- ^ 渡邉 誠也,牧野 圭祐 (2007). “微生物の糖代謝経路に見られる新規な進化学的関係”. 生化学 79: 11.
- ^ a b c H. Robert Horton 他 著『ホートン生化学(第3版)』鈴木紘一・笠井献一・宗川吉汪 監訳、東京化学同人、2003年9月、p.253-262、ISBN 4-8079-0575-9
- ^ a b c d e f g h David L. Nelson, Michael M. Cox 共著 『レーニンジャーの新生化学[上]‐第4版‐』 山科郁男 監修、川嵜敏祐ほか 編、廣川書店、2006年10月、p.742-761、ISBN 978-4-567-24402-2
- ^ John E. McMurry, Tadhg P. Begley 共著 『マクマリー 生化学反応機構 ‐ケミカルバイオロジー理解のために‐』 長野哲雄 監訳、東京化学同人、2007年9月、p.160、ISBN 978-4-8079-0648-2
- ^ ピルビン酸キナーゼの作用により、まずエノール型のピルビン酸が生成されるが、細胞内では速やかにケト型に異性化される。
- ^ クエン酸回路(TCA回路) 講義資料
- ^ 八田秀雄「新たな乳酸の見方」『学術の動向』、Vol. 11 (2006) No. 10. doi:10.5363/tits.11.10_47
- ^ 南都伸介監修『閉塞性動脈硬化症(PAD)診療の実践』南江堂、2009年。p4。[1]
- ^ Peter Richard (October 2003). “The rhythm of yeast”. FEMS Microbiology Reviews 27 (4): 547-557. doi:10.1016/S0168-6445(03)00065-2. http://onlinelibrary.wiley.com/doi/10.1016/S0168-6445(03)00065-2/abstract 2012年5月18日閲覧。.
関連項目
外部リンク
- 解糖 (英語)
- 解糖系酵素
解糖系 | |
|---|---|
| |
|---|---|
| 解糖系 |
|
| 糖新生のみの酵素 | |
| 調節 |
|
代謝、異化、同化 | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 一般 | |||||||||||||||||||||||||||||||||
| エネルギー代謝 (英語版) |
| ||||||||||||||||||||||||||||||||
| 特定経路 |
| ||||||||||||||||||||||||||||||||
| | |||||||||||||||||||||||||||||||||
代謝マップ | ||
|---|---|---|
| ||
















